عنوان الموضوع : مساعدة في الفيزياء ضروري جدا ادخلوا لو سمحتم
مقدم من طرف منتديات العندليب
السلام عليكم
الخاوة والله ماني فاهم والو فالكيمياء احماض واسس ، اكسدة وارجاع وغدا الاختبار
فياريت لو تقدروا تعاونوني في هذه الامور
مثلا متى نستعمل جدول التقدم ولماذا ؟
كيف نعين المتفاعل المحد ؟
ما الهدف من المعايرة و ما الفرق بين المعايرة بقياس الناقلية والمعايرة الاخرى نسيتها
مامعنى حمض قوي وكيف نعرفه
ما الفرق بين المعادلة النصفية والمعادلة العادية لي نعرفوها من بكري
-----
لي قدر يعاوني بجواب لسؤال واحد ما فيه مشكلة المهم يعطينا وجه
وبارك الله فيكم
>>>>> ردود الأعضـــــــــــــــــــاء على الموضوع <<<<<
==================================
>>>> الرد الأول :
السلام عليكم
للمراجعة فقط
للتفريق بين المؤكسد و المرجع نجد
المؤكسد يحمل أكبر شحنة دائما أما في حالة الشوارد المركبة فتحسب المجموع و تقارن
جدول التقدم هو من يطلب منك تقديمه تقريبا دائما فقط عليك معرفة كيفية تقديمه نحتاجوه في الباك العام الجاي ان شاء الله
المعايرة قد تكون phمترية باستعمال phمتر
قد تكون عن طريق الناقلية
و قد تكون باستعمال كواشف ملونة
و المعايرة هي معايرة محلول أساسي مجهول التركيز بمحلول حمضي معلوم التركيز
و نعلم ان الحمض أكبر من الاساس بH او اكثر
=========
>>>> الرد الثاني :
ربي يكون في عونك خويا
=========
>>>> الرد الثالث :
الله يعطيكم الصحة و ربي يوفقكم
----
ممكن اي واحد يعرف اجابة الاسئلة الباقية ياريت يفيدنا
=========
>>>> الرد الرابع :
https://www.infpe.edu.dz/COURS/Enseig...ases/INDEX.HTM احماض واسس
https://djelfa.info/vb/showthread.php?t=574843 الاكسدة و الارجاع
جدول التقدم نعرفو منو التقدم الاعظمي و المتفاعل المحد و تقدر تخرج منو التركيز تع اي عنصر اذا طلب منك
المتفاعل المحد تعرفو كيما تحسب كمية مادة المتفاعلين و لي تلقاها أقل هذاك هو المتفاعل المحد
الهدف من المعايرة تعيين التركيز المجهول للمحلول ..حيث يكون محلول السحاحة معلوم التركيز ومجهول الحجم
اما المحلول الموجود في البيشر يكون معلوم الحجم ومجهول التركيز
المعادلة النصفية تكون لكلا المتفاعلين معادلة وحدو ....دير معادلة للمؤكسد و تسمى هده معادلة نصفية للارجاع........و تزيد دير معادلة للمرجع و هده تسمى معادلة نصفية للاكسدة
أما العادية هي المعادلة الاجمالية و تكون بجمع المعادلتين السابقتين يعني هي معادلة التفاعل.
لا تنساني من صالح دعائك ............و بالتوفيق في الامتحان
=========
>>>> الرد الخامس :
الفرق بين المعادلة النصفية و العادية
المعادلة النصفية تبين لك كفية تحول النوع او الفرد الكيميائي من مؤكسد الى مرجع او مرجع الى مؤكسد
اما العادية او الكلية فهي مجموع المعادلتين النصفيتين
ملاحظة صغيرة
المعادلة النصفية توجد فقط في التفاعل اكسدة ارجاع
الهدف من المعايرة هو تحديد تركيز محلول تركيزه مجهول و بذلك يمكن استنتاج كمية مادة النوع الكيميائي
الحمض القوي دائما تجد صيغته من الشكل HnX مثال Hcl HI HBr
=========
الحمض هو كل فرد كيميائي يفقد بروتون H+
الأساس هو كل فرد كيميائي يكتسب H+
الحمض لمآ يفقد بروتون يصبح أساسا
والاساس لمآ يكتسب بروتون يصبح حمض
مثلا :
نعلمُ أن اساس + بروتون = حمض
معنآه H2O هو الاساس والحمض هو H3O
في تفاعل أي فردين كيميائيين فإننآ :
نُميزُ الأساس بــ شاردة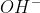
ونميزُ الحمض بالبروتون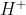
لمعايرة:
هي الطريقة التي تسمح بتعيين كمية المادة لفرد كميائي منحل في الماء
1المعيارة اللونية
نضع في كاس بيشر حجمv0من هيدروكسيد الصديوم تركيزه المولي c0 مجهول نضيف اليه قطرات من كاشف ازرق البروموتيمول الذي يتميز بلونه الاخضر فيصبح لونه ازرق وباستعمال سحاحة نضيف للمحلول السابق كلور الهيدروجين Hcl تركيزه c1 معروف وبعد اضافة حجم veمن المحلول الحمضي نلاحظ ان لون المحلول يتحول من الازرق الى الاخضر دلالة على تكافؤ كمية المادة المتافاعلين
نسمي الحجمve الللازم للحصول على التكافؤ بحجم التكافؤ
2المعايرة عن طريق قياس الناقلية
اثناء المعايرة يمكن استعمال مقايس ناقلية المحلول لمتابعة تغيرات الناقلية G للمزيج حيث يمكن تعيين حجم التكافؤ بالطريقة البيانية حيث ان نقطة تقاطع المستقيمين يسمى نقطة التكافؤ
مفهوم نقطة التكافؤ
هي تساوي كيمة مادة الحمض وكمية مادة الاساس n A=nB
cA=cB
ادا كان مثلاcBمجهولا فانvA هو ve
مفهوم الحمض والاساس
الحمض :هو كل فرد بامكانه التخلي عن بروتون H او اكثر
الاساس :هو كل فرد كيميائي بامكانه اكتساب بروتون
الاكسدة والارجاع
مفهوم المؤكسد والمرجع oxydant reducteur
تعاريف
الاكسدة oxydation:
هي عملية يتم فيها فقد الالكترونات
الارجاع reduction:
هي عملية يتم فيها اكتساب الالكترونات
المؤكسدة oxydant:
هو كل فرد كيميائي قادر على اكتساب الالكترونات (يخضع لعملية الارجاع)
المرجع reducteur:
هو كل فرد كيميائي قادر على فقد الالكترونات (يخضع لعملية الاكسدة )
الله يعطيكم ما تتمناو و يرضى عليكم ويرضي عليكم الوالدين
بارك الله فيكم
المشاركة الأصلية كتبت بواسطة hichaam 
الله يعطيكم ما تتمناو و يرضى عليكم ويرضي عليكم الوالدين
بارك الله فيكم
شكرا جزيلا على الدعاء و بارك الله فيك قبل كل شيئ هادا واجبنا موفق باذن الله في امتحانك
طلب فقط اذا استطعت ان تضع لنا الاختبار بعد انجازه غدا و سلام
الفرق بين المعادلة النصفية و العادية
المعادلة النصفية تبين لك كفية تحول النوع او الفرد الكيميائي من مؤكسد الى مرجع او مرجع الى مؤكسد
اما العادية او الكلية فهي مجموع المعادلتين النصفيتين
وايضا عندم يطلب منك معادلة نصفية ارجاع يجب ان تكون في النواتج
مرجع وعندما يطلب منك معادلة نصفية للاكسدة يجب ان تكون في النواتج
والمؤكسد دوما يكون معه الالكترونات اي زائد الكترون
وفي المعادلة الاجمالية نقوم بجمع النصفية ارجاع والنصفية للاكسدة
لتكون فيها الالكترونات
شكراااااااا على الموضوع
==================
شكرا لكم على المعلومات







 رد مع اقتباس
رد مع اقتباس